光合成細菌 RAP99 の自然免疫系の試験(in vivo,in vitro)

自然免疫系試験
マクロファージ細胞RAW267.4細胞に対するNO産生試験
目的
光合成細菌RAP99菌体の経口摂取、及び抗がん剤MMCあるいは5-FUを併用することにより、各々を単独で使用した場合と比較して腫瘍増殖抑制作用の増大、すなわち抗腫瘍作用が確認された。そこで、光合成細菌RAP99菌体の免疫活性化作用の指標として、マウスのマクロファージ細胞株RAW264.7細胞に対するNO(一酸化窒素)の産生作用について確認した。
試料と方法
(1)マクロファージ細胞及び培養条件
マウスのマクロファージ由来のRAW267.4細胞を、American Type Culture Collection(ATCC)から購入した。RAW267.4(4×106細胞/mL)をペニシリン(100単位/mL)、ストレプトマイシン(100μg/mL)及び10%加熱不活性胎児牛血清(FBS)を含むRPMI1640培地(イワキ)で湿度95%、5%一酸化炭素濃度、37℃条件下で培養した。また、7日毎に継代維持した。
(2)試料の調整
光合成細菌RAP99の凍結乾燥粉体を滅菌したリン酸緩衝生理食塩水(PBS)に懸濁して、0.001、0.003、0.01、0.03、0.1、0.3そして1 μg/mLの各濃度に試料溶液を調整した。
(3)NOの測定
細胞を96ウェルプレートに4×103細胞濃度で播種し、10%FBSを含むRPMI1640培地で24時間培養した。細胞に種々の濃度の試料を添加して、さらに24時間培養した。上清液50μLに、Griess試薬(0.5%スルファニルアミド、2.5%リン酸、0.05%ナフチルエチレンジアミン)50μLと混和した後、分光光度計(microplate reader)540nmの波長で吸光度を測定して行なった。
図1 光合成細菌RAP99菌試料溶液によるNOの産生作用
結果及び考察
RAW267.4細胞において、光合成細菌RAP99菌体試料を添加して24時間培養したときに、用量依存的なNOの産生が観察された。これにより、光合成細菌RAP99菌体の抗腫瘍作用は宿主の免疫反応を介していることが示唆された。
【試験責任者:東北薬科大学(現:東北医科薬科大学)教授 石川正明】
51Cr遊離法を用いたNK細胞活性測定試験
目的
光合成細菌RAP99菌体の経口摂取、及び抗がん剤MMCあるいは5-FUを併用することにより、各々を単独で使用した場合と比較して腫瘍増殖抑制作用の増大、すなわち抗腫瘍作用が確認された。そこで、光合成細菌RAP99菌体の免疫活性化作用の指標として、51Cr遊離法を用いたNK細胞活性試験を実施した。
試料と方法
(1)使用動物
ddY系雄性マウス(22~24g、5週齢)を日本SLC(浜松)から購入して使用した。実験期間は実験動物飼育用固形飼料(日本クレア、CE-2)と水道水を自由に摂取させ、温度23±1℃、湿度50±5%、12時間周期(明期07:00~19:00、暗期19:00~07:00)の明暗サイクル環境下で飼育した。動物実験は、東北薬科大学動物実験ガイドラインに従って行った。
(2)試料の調整
光合成細菌RAP99菌の凍結乾燥粉体を生理食塩水に懸濁して、0.0001、0.001、0.01、0.1、そして1 mg/kgの各濃度に試料溶液を調整し、1群6匹のマウスに静脈内投与した。対照試験には懸濁に用いた生理食塩水のみを用いた。投与24時間後に脾臓を摘出して2匹で1試料とした(n=3)。摘出した脾臓を分散し血液を溶血させた後に細胞数を計測した。
(3)51Cr遊離法によるNK細胞活性の測定
100μCiの51Crで標識したマウスリンパ腫由来のYAC-1細胞 (2 x 105)に対して、1:10、1:20、1:50、1:100の比率の脾臓を、96ウェルプレートを用いて4時間培養した後、NK細胞障害活性によって遊離した51Crを回収すべく遠心分離した。遠心分離して得られた上清中の遊離51Cr量を液体シンチレーションカウンターで測定し、細胞障害活性(%)を算出した。
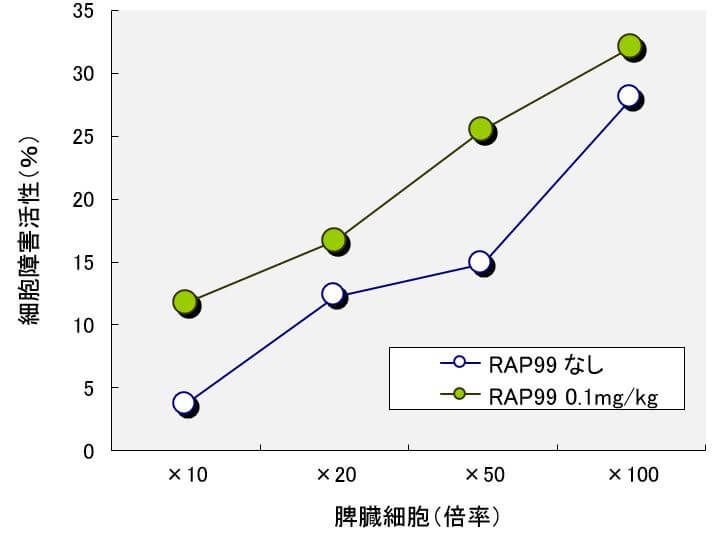
図1 光合成細菌RAP99菌試料溶液0.1mg/kgにおけるNK細胞活性の誘導
結果
図1に示すように1:10、1:20、1:50、1:100の比率の培養試験において、NK活性の誘導が観察された。特に、光合成細菌RAP99菌体試料溶液0.1mg/kgの投与により、著明なNK細胞活性の誘導が観察された。これにより、光合成細菌RAP99菌体の抗腫瘍作用は宿主の免疫反応を介していることが示唆された。
【試験責任者:東北薬科大学(現:東北医科薬科大学)教授 石川正明】
マクロファージ細胞RAW267.4細胞に対するTNF-α産生試験
目的
光合成細菌RAP99菌体の経口摂取、及び抗がん剤MMCあるいは5-FUを併用することにより、各々を単独で使用した場合と比較して腫瘍増殖抑制作用の増大、すなわち抗腫瘍作用が確認された。そこで、光合成細菌RAP99菌体の免疫活性化作用の指標として、マウスのマクロファージ細胞株RAW264.7細胞に対するTNF-αの産生作用について確認した。
試料と方法
(1)マクロファージ細胞及び培養条件
マウスのマクロファージ由来のRAW267.4細胞を、American Type Culture Collection(ATCC)から購入した。RAW267.4(4×106細胞/mL)をペニシリン(100単位/mL)、ストレプトマイシン(100μg/mL)及び10%加熱不活性胎児牛血清(FBS)を含むRPMI1640培地(イワキ)で湿度95%、5%一酸化炭素濃度、37℃条件下で培養した。また、7日毎に継代維持した。
(2)試料の調整
光合成細菌RAP99菌の凍結乾燥粉体を滅菌したリン酸緩衝生理食塩水(PBS)に懸濁して、0.001、0.003、0.01、0.03、0.1、0.3そして1 μg/mLの各濃度に試料溶液を調整した。
(3)TNF-αの測定
細胞を96ウェルプレートに4×103細胞濃度で播種し、10%FBSを含むRPMI1640培地で24時間培養した。細胞に種々の濃度の試料を添加して、さらに24時間培養した。TNF-αの定量はMouse TNF-α Immunoassay Kit (Biosource)のプロトコールにしたがい、上清液50μLを用いて450nmの波長で吸光度を測定して行なった。
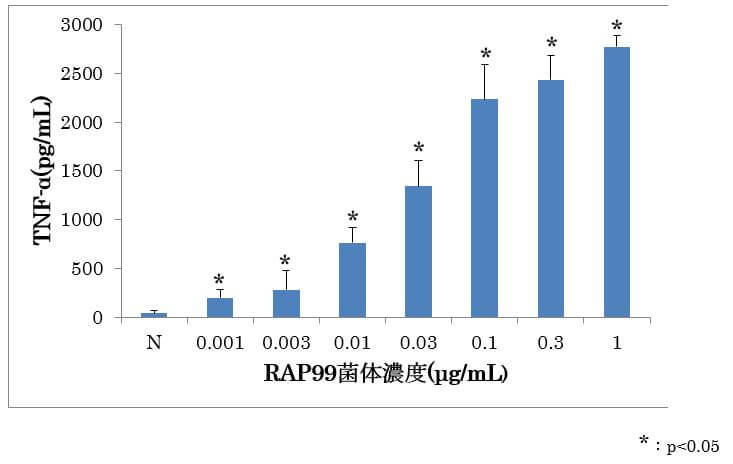
図1 光合成細菌RAP99菌試料溶液によるTNF-αの産生作用
結果及び考察
RAW267.4細胞において、光合成細菌RAP99菌体試料を添加して24時間培養したときに、用量依存的なTNF-αの産生が観察された。これにより、光合成細菌RAP99菌体の抗腫瘍作用は宿主の免疫反応を介していることが示唆された。
【試験責任者:東北薬科大学(現:東北医科薬科大学)教授 石川正明】
HEK293細胞を用いたTLR活性化確認試験
目的
光合成細菌RAP99菌体(以下RAP99)および光合成細菌RAP99由来LPS(以下RAP99-LPS)のマクロファージ活性化の経路について、TLR2、4、9に関してそれらの遺伝子を導入したHEK293細胞を用いて明らかにする。
試料と方法
1.試験材料
(1)被験液の調製
①RAP99-LPS
RAP99-LPSは注射用水(日本薬局方、株式会社大塚製薬工場)に2mg/mLになるように溶解し4℃にて保存しているものを、使用時に37℃で5分間加温した後、37℃で超音波処理を1分間行った。処理後、990μLの培養液に10μLを加えよく混ぜ、20μg/mLの溶液を調製した。以降作製した溶液100μLを900μLの培養液に加える操作を繰り返し、10倍の希釈系列を作製した。
②RAP99熱水抽出物
RAP99凍結乾燥菌体粉末を1.5mLのチューブに測りとり、試料20mg に対し、1mLの蒸留水を加え、ボルテックスミキサーでよく攪拌したのち、ヒートブロック上(100℃)で20分間抽出を行った。抽出後、15000gで10分間遠心分離を行い、上澄みをサンプル(20mg/mL)として使用した。
③RAP99粉砕懸濁液
RAP99凍結乾燥菌体粉末を1.5mLのチューブに測りとり、試料20mg に対し、1mLの蒸留水を加え、酸およびアルカリ処理を施したエンドトキシンフリーの無菌ガラスビーズを加え、ボルテックスミキサーで10分攪拌・粉砕して懸濁液を調整した。本懸濁液をサンプル(20mg/mL)として使用した。
(2)細胞株
①TLR遺伝子導入HEK細胞株
本細胞株はヒト胎児腎細胞293(HEK293)にTLRなどのタンパク質の遺伝子を導入して形質転換させたもので、リガンドが各TLRに結合すると、その指標としてIL-8が産生されるよう設計されている。
InvivoGen社より購入したものを用いた。同社より購入したTLR遺伝子導入HEK細胞株は以下の通り。
・TLR null(TLR遺伝子の導入無し)
・TLR2
・TLR4
・TLR9
・TLR4/MD2/CD14(TLR4およびその共受容体であるMD2とCD14の遺伝子も導入)
なお、TLR4/MD2/CD14のみマウスの遺伝子を導入した細胞株で、他はヒトの遺伝子を導入した細胞株である。
②当該細胞株の選択理由
当該TLR遺伝子導入HEK細胞株は、各TLRのリガンドに対して感受性が高く、被験物のTLR活性化経路を明らかにする目的で開発、使用されている細胞株であるため。
③細胞株の保存及び準備
入手したTLR遺伝子導入HEK細胞株は37℃に加温した液で急速解凍した。解凍した液を直ちに、新鮮な培養液を10mL加えた15mLコニカルチューブに移し、1000rpm(190×g)で5分間遠心分離を行い、上清をデカント(容器を静かに傾ける操作)により捨てた。
細胞の沈殿に、培養液(10%FBS、100U/mLペニシリン、100U/mLストレプトマイシン、DMEM)10mLを加え静かに懸濁し、液をT25培養フラスコに移した。T25培養フラスコを37℃の5%CO2インキュベーターで培養した。
細胞が1×106cells/mL程度になった時点で、ピペッティングにより壁に付着している細胞を剥がし、得られた細胞懸濁液の一部を用いて細胞数と生存率を計測した。
残りの細胞懸濁液を15mLコニカルチューブに移し、1000rpmで5分間遠心分離を行い、上清をデカントにより捨てた。細胞の沈殿をタッピングにより分散させた後、凍結保存用のセルバンカーを1×106cells/mLになるように加え、静かに懸濁し、1.0mLずつをセラムチューブに移した。
細胞を入れたセラムチューブは予め冷蔵しておいたバイセルに入れ、-80℃で凍結保存した。凍結保存した細胞を戻したものを試験に供した。
(3)対照物質
①陰性対照物質
被験物質の希釈に用いる培養液を陰性対照物質とした。
②陽性対照物質
◎TLR2、TLR9
・乳酸菌死菌。用量は、終濃度1mg/mL、100 μg/mL、10 μg/mL、1 μg/mL、0.1 μg/mLおよび0.01μg/mLとした。
◎TLR4、TLR4/MD2/CD14
・小麦やサツマイモとの共生で知られるグラム陰性菌パントエア・アグロメランス(Pantoea agglomerans)から抽出精製したLPS(以降、LPSpと略記)。用量は、終濃度10μg/mL、1μg/mL、100 ng/mL、10 ng/mL、1 ng/mL、0.1 ng/mLおよび0.01ng/mLとした。
希釈操作は全てクリーンベンチ内にて実施した。注射用水に2.5mg/mLになるように溶解し4℃にて保存しているものを、使用時に37℃で5分間加温した後、37℃で超音波処理を1分間行った。処理後、992μLの培養液に8μLを加えよく混ぜ、20μg/mLの溶液を調製した。以降作製した溶液100μLを900μLの培養液に加える操作を繰り返し、10倍の希釈系列を作製した。
(4)試薬調製
①培養液の調製
調製した培養液は4℃にて保存した。
②PBS(-)溶液
PBS(-)100mLに蒸留水を加えて1Lにした。121℃にて20分間、高圧蒸気滅菌を行い室温で保存した。
③0.5%(w/v)トリパンブルーPBS(-)溶液
トリパンブルー250mgにPBS(-)を加え50mLにした。この液5mLずつを15mLコニカルチューブに分注し、室温にて保存した。
2.試験方法
(1)試験方法概略
各TLR導入HEK細胞を試験液で24時間処理した後、培養液を回収し、培養液中のIL-8濃度をELISAにより測定した。
(2)前培養
各TLR導入HEK細胞およびTLR null導入HEK細胞は、調整培養液にて継代培養したものを用いた。培養はT25培養フラスコを用い、3日あるいは4日毎に0.5~1×105cells/mLで植え継いだ。37℃の5%CO2インキュベーター内で培養した。
(3)試験操作
試験操作は全てクリーンベンチ内で行った。
①T25培養フラスコにて前培養した各TLR導入HEK細胞をピペッティングにより壁から剥がし、得られた細胞の懸濁液を50mLコニカルチューブに移した。チューブを室温で1000rpm(190×g)、5分間遠心分離を行い、上清をデカンテーションで捨て、細胞をペレットとして回収した。
②タッピングにより細胞をほぐした後、細胞ペレットに培養液5mLを加え、ピペッティングによって細胞を均一に懸濁した。その後、11μLを別のチューブに移し0.5%トリパンブルーを添加した後、血液計算板に液を移して細胞数と生存率を測定した。生存率(トリパンブルーで核が染色されない細胞を生細胞、核が青く染色される細胞を死細胞として、生細胞/(生細胞数+死細胞数)×100を算出)が、90%以上であったので、残りを試験に用いた。
③測定した細胞数に基づいて、残液に培養液を加えて細胞数が4×105cells/mLになるよう調製した。得られた細胞懸濁液を100μLずつ96well平底プレート4枚の各ウェルに加え37℃の5%CO2インキュベーターで、24時間、前培養を行った。前培養終了後、培養液を新鮮な培養液100μLで洗浄した。
④被験液は、終濃度の2倍濃度のものを調製し、各ウェルに100μLずつ加えた。各検体を添加後、24時間培養した。
⑤各ウェルからの培養上清をIL-8のELISA測定に用いた。培養上清は測定実施まで-80℃で保存した。
(4)IL-8 ELISA測定
Biolgend社のHuman IL-8 ELISA測定キットの取扱説明書に従った。
(5)試験系の成立条件
培地のみの場合に比べ、各陽性対照物質で刺激した場合に、培養液中のIL-8濃度が有意に高い値を示すことかつ、LPSpを含む培養液の試験群でIL-8が産生していた場合、問題なく試験が行われたと判断した。本試験ではこの条件を満たしており、試験は適切に行われたと考えられた。
結果及び考察
1.結果
各TLR遺伝子導入HEK細胞(TLR2、TLR4、TLR null、TLR9およびTLR4/MD2/CD14)を用いた結果について以下に示した。
①TLR null導入HEK細胞(null HEK細胞)
陰性対照のmedium群と他の群において、ほぼIL-8の誘導は認められなかった(表1、図1)。TLR null導入HEK細胞にはTLR遺伝子を導入していないので妥当な結果である。
表1 TLR null HEK細胞におけるIL-8産生
図1 TLR null HEK細胞におけるIL-8産生
図はy軸片対数グラフであり、図中のカラムとバーはn=3の平均値とSDを示す。
②TLR4導入HEK細胞
試料の各用量におけるIL-8濃度の数値については、バラつきが大きく有意性に欠け、用量依存性などの明確な傾向が認められなかった。この点については、TLR4のみではなく、共受容体であるMD2およびCD14を加えた3種のタンパク遺伝子を導入したHEK細胞を用いることにより、明確になる可能性が高いと考えられた。
表2 TLR4導入HEK細胞におけるIL-8産生
図2 TLR4導入HEK細胞におけるIL-8産生
図はy軸片対数グラフであり、図中のカラムとバーはn=3の平均値とSDを示す。
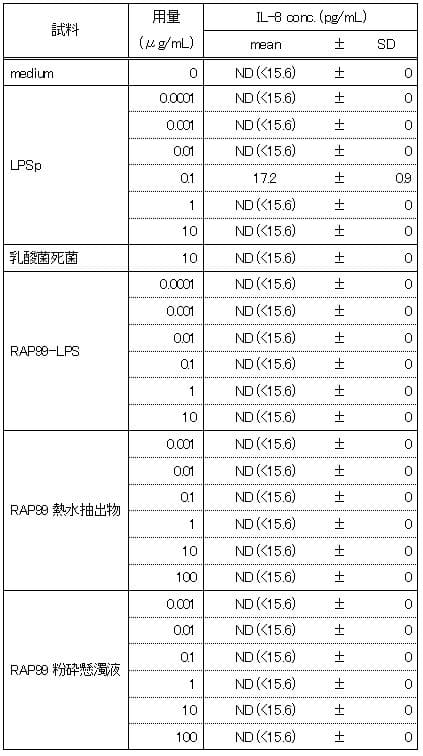
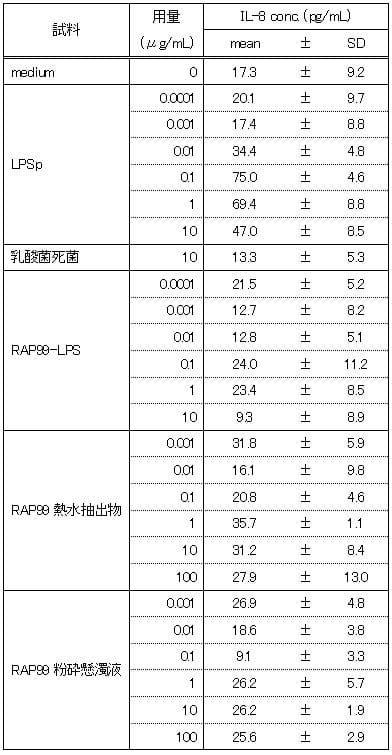
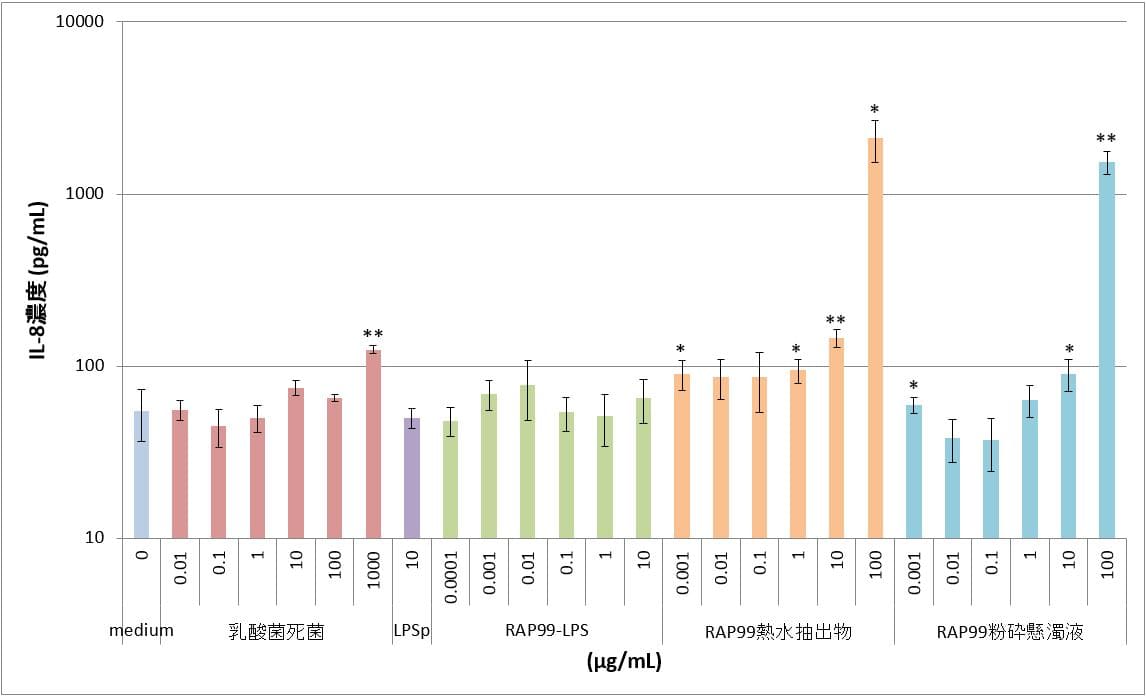
③TLR2導入HEK細胞
陽性対照のLPSpでは10μg/mLの濃度においてもmedium群と同程度のIL-8濃度を示し、IL-8の誘導は認められなかった。RAP99-LPSは0.1μg/mL~10μg/mLの用量において、IL-8の誘導は認められなかった。RAP99熱水抽出物と粉砕懸濁液では、用量依存的なIL-8の誘導が認められたので、IL-2のリガンドを含んでいることが推測される。RAP99粉砕懸濁液の方がRAP99熱水抽出液と比べて同一濃度でより高い値を示した。
表3 TLR2導入HEK細胞におけるIL-8産生
図3 TLR2導入HEK細胞におけるIL-8産生 **:p<0.01
図はy軸片対数グラフであり、図中のカラムとバーはn=3の平均値とSDを示す。
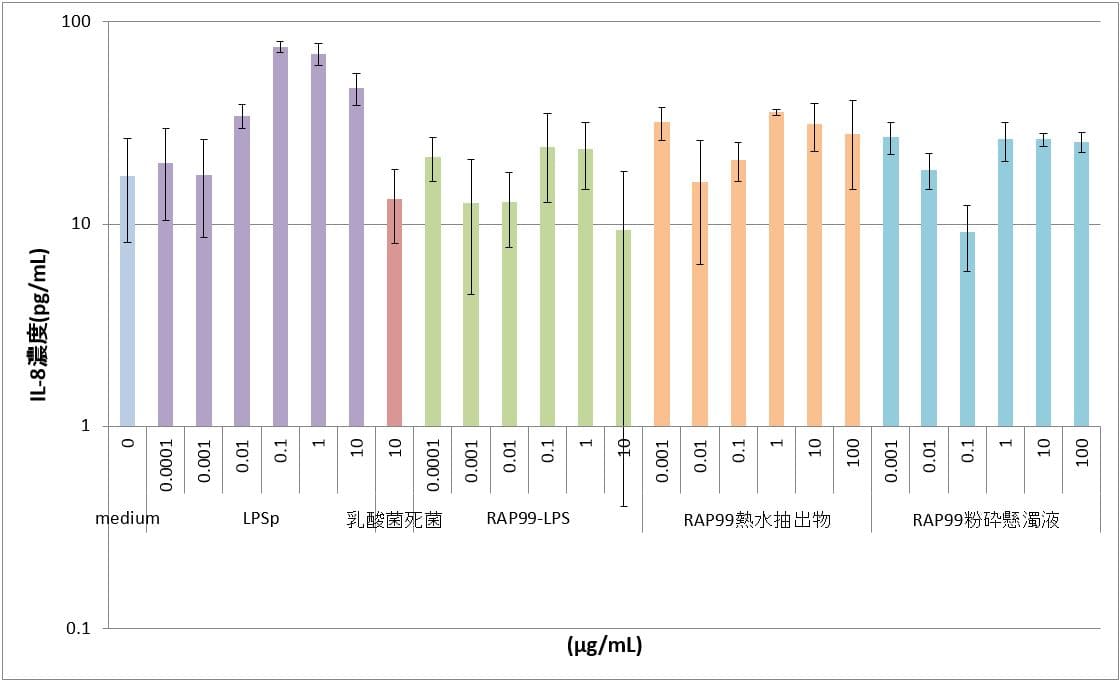
④TLR9導入HEK細胞
陽性対照のLPSpでは最高用量の10μg/mLの濃度においてもmedium群と同程度のIL-8濃度を示し、IL-8の誘導は認められなかった。RAP99-LPSは0.1ng/mLから10μg/mLの用量において、IL-8の誘導は認められなかった。RAP99熱水抽出物と粉砕懸濁液では、用量依存的なIL-8の誘導が認められた。RAP99熱水抽出物の方がRAP99粉砕懸濁液と比べて同一濃度でより高い値を示した。
表4 TLR9導入HEK細胞におけるIL-8産生
図4 TLR9導入HEK細胞におけるIL-8産生 **:p<0.01、*:p<0.05
図はy軸片対数グラフであり、図中のカラムとバーはn=3の平均値とSDを示す。
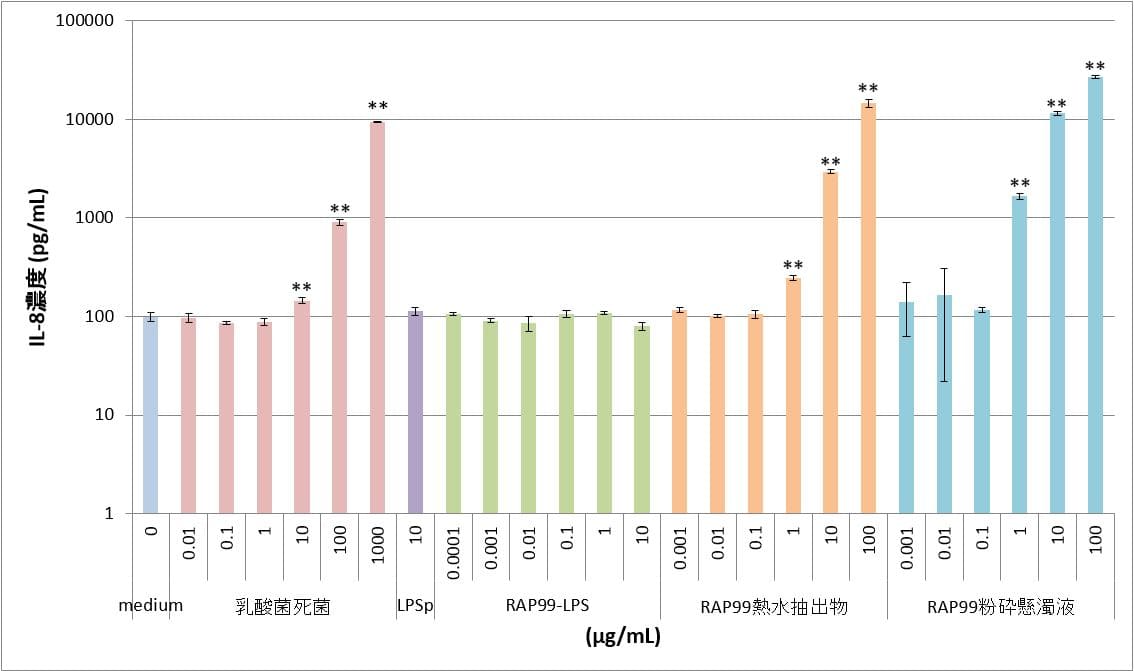
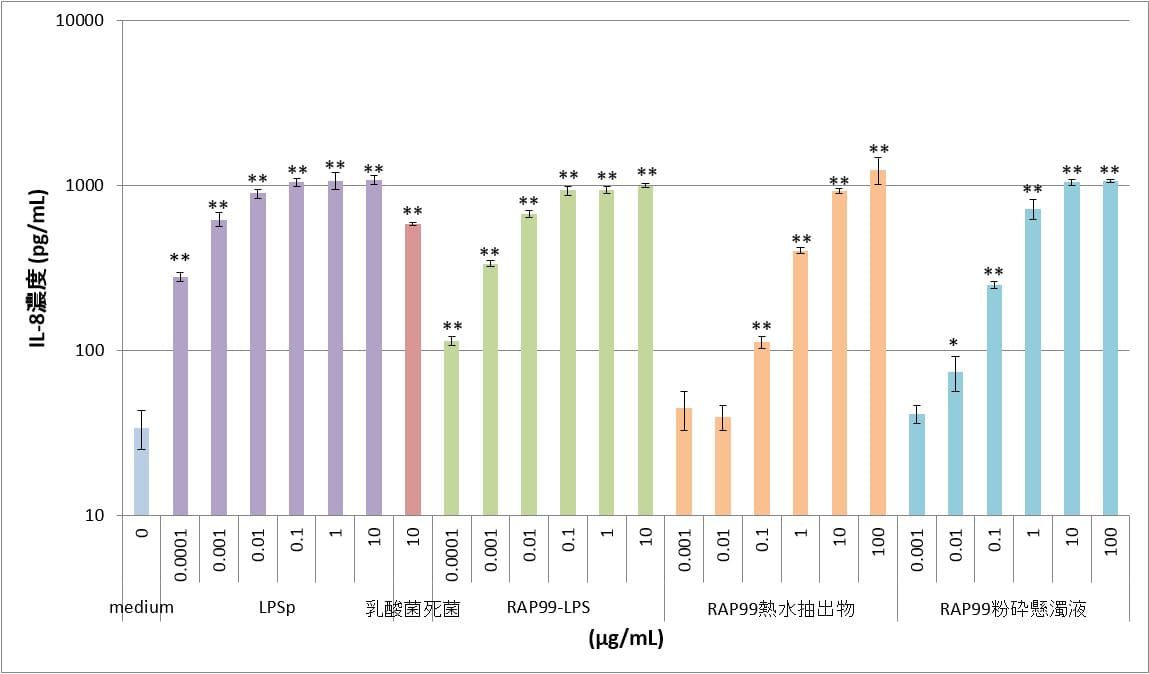
⑤TLR4/MD2/CD14導入HEK細胞
陽性対照のLPSpおよびRAP99-LPSでは、0.0001μg/mLから10μg/mLの用量において、用量依存的なIL-8の産生が認められ、0.1μg/mL以上の用量においてはプラトーに達した。RAP99熱水抽出物では0.1μg/mLから100μg/mLの用量において、RAP99粉砕懸濁液では0.01μg/mLから100μg/mLの用量において、用量依存的なIL-8の産生が認められた。明確な用量依存傾向が認められた理由は、TLR4単体だけではなくコレセプターMD2およびCD14の遺伝子を導入したHEK細胞を用いたためであると考えられる。
表5 TLR4/MD2/CD14導入HEK細胞におけるIL-8産生
図5 TLR4/MD2/CD14導入HEK細胞におけるIL-8産生 **:p<0.01、*:p<0.05
図はy軸片対数グラフであり、図中のカラムとバーはn=3の平均値とSDを示す。
2.考察
(1)RAP99-LPS
RAP99-LPSについては、マウスのTLR4/MD2/CD14導入HEK細胞を用いた測定において、用量依存的なIL-8の産生が認められたことから、TLR4に対するリガンドであることが明らかとなった。他のTLR2とTLR9の経路の測定ではIL-8の産生が認められていないことから、TLR4に対する特異性が高いことが明らかとなった。
ヒトTLR4導入HEK細胞の測定では、有意なIL-8の上昇は認められなかったが、マウスのTLR4/MD2/CD14導入HEK細胞を用いると有意な用量依存性が認められたことから、TLR4を活性化するためには共受容体であるMD2およびCD14の存在が必要であることが示唆された。
(2)RAP99抽出物
RAP99抽出物に関しては、熱水抽出物と粉砕懸濁液について、各種のTLR経路での反応性について測定した。その結果より、TLR2、4および9のいずれの経路においてもIL-8の産生が認められていることから、各経路のリガンド効果を示しているものと考えられた。具体的なリガンドとしては、TLR2に対してはペプチドグリカン、TLR9に対しては核酸であることが推測される。
表6 各試料のTLR活性化の結果まとめ
【試験責任者:自然免疫応用技研株式会社】