光合成細菌 RAP99 の抗腫瘍系試験(in vivo)

抗腫瘍系試験
マウス肉腫細胞サルコーマ180(Sarcoma180)を用いた固形がんに対する抗腫瘍試験
目的
光合成細菌RAP99菌体の抗腫瘍作用の有無を確認するため、マウス肉腫由来のSarcoma-180(S-180)を用いた腫瘍増殖抑制試験を実施した。
試料と方法
(1)使用動物
ddY系雄性マウス(22~24g、5週齢)を日本SLC(浜松)から購入して使用した。実験期間は実験動物飼育用固形飼料(日本クレア、CE-2)と水道水を自由に摂取させ、温度23±1℃、湿度50±5%、12時間周期(明期07:00~19:00、暗期19:00~07:00)の明暗サイクル環境下で飼育した。動物実験は、東北薬科大学動物実験ガイドラインに従って行った。
(2)腫瘍細胞
S-180は東北大学附属医用細胞資源センターより分与された。S-180は、ddY系雄性マウス腹腔内に1×106個を移植して継代維持した。実験には移植後1週間経過した細胞を用いた。その後、ペニシリン(100単位/mL)、ストレプトマイシン(100μg/mL)及び10%加熱不活性胎児牛血清(FBS)を含むRPMI1640培地(イワキ)で湿度95%、5%一酸化炭素濃度、37℃条件下で培養した。細胞数はトリパンブルー法により計測した。
(3)試料の調整
光合成細菌RAP99菌体の凍結乾燥粉体を、用事調整で生理食塩水に懸濁して試料溶液を作成した。濃度は0.001、0.01、0.1mg/kgの各濃度となるように調整した。対照試験には懸濁に用いた生理食塩水のみを用いた。マイトマイシンC(MMC)及び5-フルオロウラシル(5-FU)は協和発酵から購入して使用した。MMCは0.02mg/kg、5-FUは0.5mg/kgとなるように調整した。
(4)腫瘍増殖抑制活性の測定
実験には1群10匹のマウスを用いた。106個のS-180をマウスの左大腿部皮下に接種し、投与スケジュールにしたがい、所定の濃度の光合成細菌RAP99菌体をマウス用経口ゾンデで投与した。抗がん剤は腹腔内に1日1回投与した。腫瘍細胞接種18日後にマウスを頸椎脱臼法で殺し、左右両肢の皮膚を剥離した後に大腿部基部から足首まで切断した。左肢の右肢に対する重量差をもって、腫瘍重量とした。各群の平均重量を求め、同時に実施した対照の生理食塩水液投与群の平均重量差を用い、腫瘍抑制率を算出した。
(5)S-180の摂取及び試料の投与
106個のS-180をマウスの大腿部皮下に接種(0.2mL/マウス)し、24時間後から1日1回10日間、光合成細菌RAP99菌体試料は経口投与、抗がん剤は腹腔内に投与した。がん細胞を接種して18日後に腫瘍重量を測定し、各群の平均腫瘍重量を求め、同時に測定した対照の整理食塩液投与群の平均腫瘍重量との比較から腫瘍増殖抑制率を算出した。
図1 光合成細菌RAP99のMMC及び5-FUとの同時使用による抗腫瘍作用
結果・考察
光合成細菌RAP99菌体試料 単独投与群では、0.001 mg/kgで 15.0%、0.01 mg/kgで26.6%、0.1 mg/kgで27.8% の腫瘍増殖抑制作用が観察された。
MMC 0.03 mg/kg 単独投与群では 25.1%、光合成細菌RAP99菌体試料と併用することにより、光合成細菌RAP99菌体 0.001 mg/kgで 42.5%、 0.01mg/kgで45.2% の腫瘍増殖抑制作用が観察された。
5-FU 0.5 mg/kg 単独投与群では 15.2%、光合成細菌RAP99菌体試料と併用することにより、光合成細菌RAP99菌体 0.001mg/kgで 46.3%、0.01mg/kgで45.1% の腫瘍増殖抑制作用が観察された。
MMCと光合成細菌RAP99菌体試料 0.001 mg/kg、あるいは 5-FU と光合成細菌RAP99菌体試料 0.001あるいは0.01 mg/kgとの併用により腫瘍増殖抑制作用の増強が観察された。
【試験責任者:東北薬科大学(現:東北医科薬科大学)教授 石川正明】
ルイス肺がん細胞(3LL)を用いた抗腫瘍作用評価試験
目的
光合成細菌RAP99菌体の様々な薬理作用について、関与している含有成分を有効成分として検討するため、その候補化合物の一つであるリポ多糖(以下RAP99-LPSと表記)の腫瘍増殖抑制効果を、Lewis肺がん細胞3LLを用いて確認した。
試料と方法
(1)使用動物
雄性のC57 BL/6Jマウス(20g~23g、実験開始時7週齢)を日本クレア株式会社から購入して使用した。動物実験は香川大学動物施設にて実施し、また、動物の管理は動物施設の規則に従って行った。動物搬入後、1週間の予備飼育を行い、餌(CE-2固形飼料)および水は自由摂取とした。
(2)腫瘍細胞
ルイス肺がん由来細胞株(Lewis lung carcinoma:3LL、以下3LLと表記)は、国立研究開発法人 医薬基盤・健康・栄養研究所のJCRB細胞バンクより凍結細胞を入手した。その後、3LLをin vitroで培養した後、C57BL/6マウスを用いてin vivoで2回継代培養したものを試験に用いた。
(3)試料溶液の調整
①陰性対照物質
RAP99-LPSの溶解に用いた生理食塩水を陰性対照物質とした。
②陽性対照物質
Poly(I:C) (Polyinosinic-polycytidylic acid sodium salt、InvivoGen)を陽性対照物質として用いた。
③RAP99-LPS
RAP99-LPSについては、注射用水(日本薬局方、株式会社大塚製薬工場)に2mg/mLになるように溶解し4℃にて保存しているもの使用した。使用時に37℃で5分間加温した後、37℃で超音波処理を1分間行った。処理後、975μLの生理食塩水に25μLを加えよく混ぜ、50μg/mLの溶液を調製した。
④抗がん剤
併用する抗がん剤シクロホスファミド(以下CPAと表記)については、和光純薬工業株式会社のシクロホスファミド-水和物を用いた。
(4)腫瘍増殖抑制試験
3LL細胞を2×105cells/50μL/マウスの割合で、C57BL/6マウスの腹部皮内に移植した。一定の腫瘍サイズ(直径で5mm程度)になった時点(移植後8日目)で腫瘍サイズに基づいて群分し、表1に示した試験群にBP0899-LPS試料溶液およびCPAを投与した。投与ルートは、RAP99-LPSは腹腔内投与または給水瓶による自由摂取、CPAは腹腔内投与とした。
腫瘍径を、RAP99-LPS投与開始日を0日目として3日ごとに測定した。RAP99-LPSの腹腔内投与は腫瘍サイズ計測後に行い、自由摂取の給水瓶は3日ごとに交換した。対照群(溶媒投与群)の腫瘍サイズに比較して抑制効果が認められるかを調べた。試験は、1群6匹のマウスを用い、12群で実施した。
(5)腫瘍体積の算出
ノギスを用いて腹部の腫瘍の長径と短径を測定した。腫瘍体積は下記の計算式を用いて算出した。
計算式:長径(mm)×短径の2乗(mm2)×0.4=腫瘍体積(mm3)
結果・考察
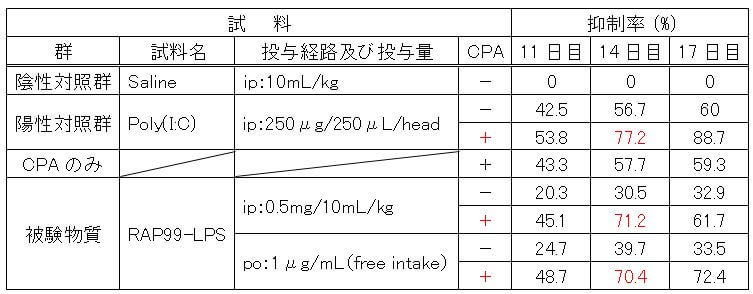
表1 RAP99-LPSとCPAの併用によるLewis肺がん細胞3LLに対する増殖抑制作用
ip:腹腔内投与、po:経口投与
(1)陽性対照
陽性対照として用いたPoly(I:C) 腹腔内投与群では、陰性対照群に比べ、投与開始後11~17日において42.5%から60%の抑制率を示した。11日目と14日目は有意に低い腫瘍体積を示した。
Poly(I:C)とCPA併用群では、11~17日目において、53.8%から88.7%の抑制率を示した。11日目と14日目は有意に低い腫瘍体積を示した。
(2)抗がん剤CPAのみ
CPAのみの群では、11~17日目において、43.3%から59.3%の抑制率を示した。11日目、14日目および17日目において有意に低い腫瘍体積を示した。
(3)RAP99-LPS
RAP99-LPSの腹腔内投与群では、RAP99-LPS単独投与群で11~17日目において20.3%から32.9%の抑制率を示し、14日目において有意に低い腫瘍体積を示した。CPA併用群で11~17日目において45.1%から71.2%の抑制率を示し、11日目、14日目において有意に低い腫瘍体積を示した。
経口投与群では、RAP99-LPS単独投与群で11~17日目において24.7%から33.5%の抑制率を示し、14日目において有意に低い腫瘍体積を示した。CPA併用群で11~17日目において48.7%から72.4%の抑制率を示し、11日目、14日目および17日目において有意に低い腫瘍体積を示した。
(4)考察
抗腫瘍効果の作用機序に関しては、Poly(I:C)の腹腔内投与により、TLR3/TICAM-1経路を介して、腫瘍に浸潤している腫瘍随伴マクロファージ(TAM:腫瘍の増殖をサポートするようなマクロファージ)から抗腫瘍性を示すマクロファージに変換されることを、Shimeらが明らかにしている1)。この結果により、Poly(I:C)の投与により腫瘍中に浸潤するマクロファージ(TAM)において、TICAM-1経路で誘導されるTNF-α、及びM1型マクロファージへの変化が抗腫瘍活性を誘起するのに重要であるとShimeらは考察している。
Shimeらの結果と考察を参考にすると、BP0899-LPSの場合も同様であると推測される。RAP99-LPSはTLR4のリガンドであり、TLR4経路が主なシグナル伝達の経路である。TLR4経路では、MyD88経路とTRIF/TICAM-1の経路の2種類が活性化されることより、腫瘍内でのTNF-α、及びTAMのM1型への変化が抗腫瘍効果に重要な役割を担っているものと推定された。
【参考文献】
1) Shime H et al., Toll-like receptor 3 signaling converts tumor-supporting myeloid cells to tumoricidal effectors, Proc Natl Acad Sci U S A. 2012 Feb 7;109(6):p.2066-p.2071.
【試験責任者:自然免疫応用技研株式会社】